Celution系统全球认证情况
Celution®系统在全世界范围内50个以上国家或地区获得相关注册许可,供研究者和商业客户进行操作和使用。
- 中国
- 欧盟CE认证
- 澳大利亚
- 日本
- 新加坡
-
Celution®系统已于2015年获得CFDA(国家食品药品监督管理局)一类医疗器械备案,可以用于人体脂肪组织再生细胞的分离。

-
Celution®系统于2006年通过了欧盟CE标志认证,获得了销售许可并持续医学临床应用许可。Celution®系统在欧盟获批使用于下列医学适应症中组织的替换、修复、再造等流程:
• 克罗恩病患者的直肠阴道瘘
• 肛窦瘘
• 皮肤、脂肪、肌肉和筋膜的缺陷或损伤
• 软组织创伤,外伤、糖尿病、缺血或辐射损伤引起的溃疡或瘘
• 组织缺血
• 表皮硬化症
除此之外,该系统还用于外科手术造成的软组织缺陷(最大缺陷容量150毫升,最大增容体积260毫升)
• 吸脂缺损,例如腹部、背部、大腿和臀部的缺损
• 先天性软组织不对称,比如胸部和面部的不对称
• 软组织构造上的缺陷,例如胸部、臀部和面部的构造缺陷
• 软组织萎缩性紊乱,例如手部和面部的软组织萎缩
• 手术导致组织缺损,例如乳腺切除术和乳房肿瘤切除术

-
Celution®系统已于2012年在药物管理局(TGA)登记注册。患者根据特别用药制度(SAS)和授权处方(AP)可以通过澳大利亚医疗用品登记处(ARTG)购买到本公司的产品,目前在澳大利亚已经开展乳腺切除后乳房重建、退行性关节炎、运动损伤的治疗,正在探索用于慢性心肌梗塞的修复。

-
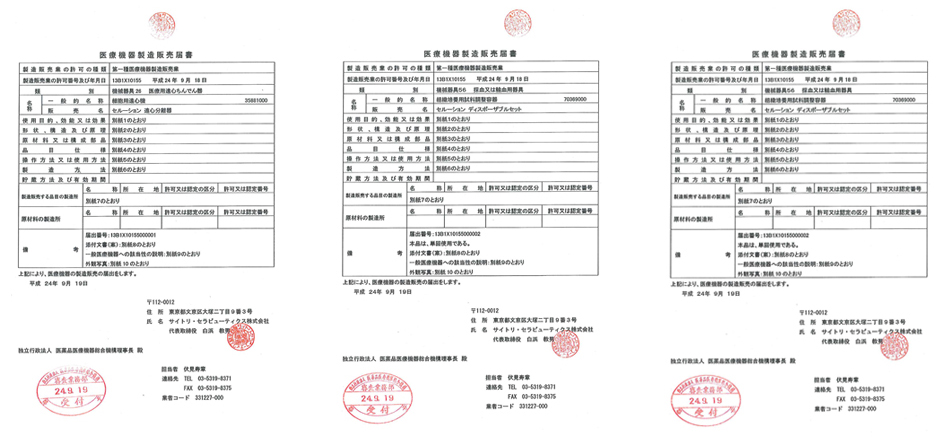
Celution®系统被劳动厚生省(MHLW)认定为医疗器械。本产品目前经劳动厚生省(MHLW)批准,已经在医学美容、男性压力性尿失禁、顽固性瘘管、肝硬化、乳房再造、缺血性心脏病、重症肢体缺血等病症方面开展临床应用。
-
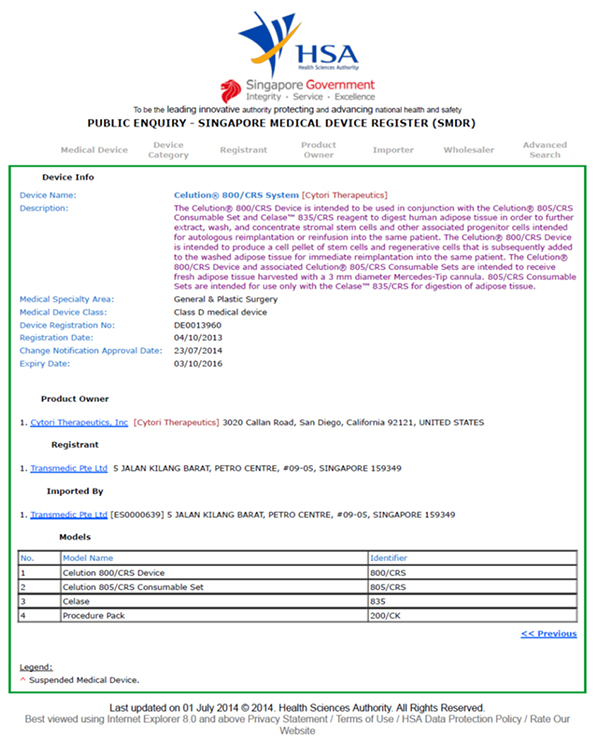
Celution®系统已于2013年获得SMDR(新加坡卫生科学局)进行注册,用于从人体脂肪组织分离脂肪来源的再生细胞。

 微信公众平台
微信公众平台